Karbohidrat
Karbohidrat
adalah kelas yang paling berlimpah senyawa organik yang ditemukan dalam
organisme hidup. Mereka berasal
sebagai produk dari fotosintesis , suatu kondensasi reduktif endotermik karbon
dioksida membutuhkan energi cahaya dan klorofil pigmen.
n
CO 2 + n H 2 O + energi
|
Seperti
dicatat di sini, rumus banyak karbohidrat dapat ditulis sebagai hidrat karbon,
C n (H 2 O) n , maka nama mereka. Karbohidrat merupakan sumber utama
energi metabolik, baik untuk tanaman dan hewan yang bergantung pada tanaman
untuk makanan. Selain dari gula
dan pati yang memenuhi peran penting gizi, karbohidrat juga berfungsi sebagai
bahan struktural (selulosa), komponen dari transportasi energi senyawa ATP ,
situs pengakuan pada permukaan sel, dan salah satu dari tiga komponen penting
dari DNA dan RNA.
Karbohidrat disebut saccharides atau, jika mereka relatif kecil, gula. Beberapa klasifikasi karbohidrat telah terbukti bermanfaat, dan diuraikan dalam tabel berikut.
Karbohidrat disebut saccharides atau, jika mereka relatif kecil, gula. Beberapa klasifikasi karbohidrat telah terbukti bermanfaat, dan diuraikan dalam tabel berikut.
|
||||||
|
||||||
|
||||||
|
1. Glukosa
Karbohidrat telah
diberikan non-sistematik nama, meskipun akhiran ose umumnya digunakan. Karbohidrat yang paling umum adalah glukosa (C 6 H 12 O 6 ). Menerapkan
ketentuan yang ditetapkan di atas, glukosa adalah monosakarida, sebuah
aldohexose (catatan bahwa klasifikasi fungsi dan ukuran digabungkan dalam satu
kata) dan mengurangi gula. Struktur
umum dari glukosa dan aldohexoses lain didirikan oleh reaksi kimia sederhana. Diagram berikut menggambarkan jenis
bukti yang dianggap, meskipun beberapa reagen ditampilkan di sini berbeda dari
yang digunakan oleh para ilmuwan yang asli.
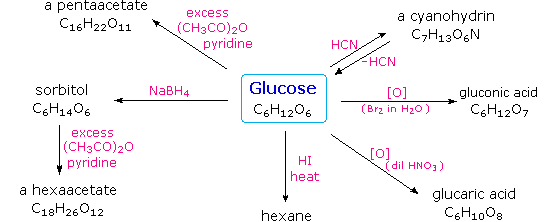
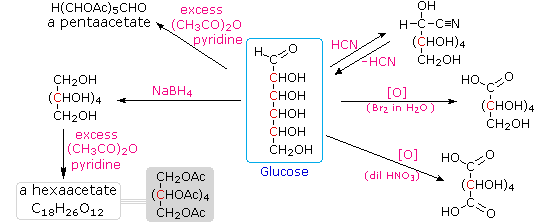
Asam
hydriodic Hot (HI) sering digunakan untuk menghilangkan reductively kelompok
fungsional dari molekul oksigen, dan dalam kasus glukosa pengobatan ini
memberikan heksana (yield rendah). Dari
sini dapat disimpulkan bahwa enam karbon dalam rantai bercabang. Kehadiran gugus karbonil aldehida itu
disimpulkan dari pembentukan sianohidrin, pengurangan ke hexa-alkohol sorbitol,
juga disebut glucitol, dan oksidasi ringan sampai asam mono-karboksilat, asam
glukuronat. Oksidasi agak kuat
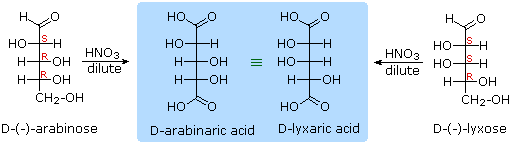
oleh asam nitrat encer memberikan asam, diacid glucaric, mendukung usulan dari
rantai enam karbon. Kelima
oksigen yang tersisa di glukosa setelah aldehid dipertanggungjawabkan yang
diduga berada di gugus hidroksil, karena turunan penta-asetat dapat dibuat. Kelompok-kelompok hidroksil
ditugaskan, masing-masing, dengan lima atom karbon terakhir, karena gugus hidroksil geminal relatif normal tidak stabil terhadap
senyawa karbonil terbentuk oleh hilangnya air. Dengan mengklik pada diagram di
atas , maka
akan berubah untuk menampilkan produk-produk yang disarankan dan struktur kotor
glukosa. Keempat atom karbon
tengah dalam rantai glukosa merupakan pusat kiralitas dan berwarna merah.
Glukosa dan sakarida lainnya secara luas dibelah oleh asam periodik, berkat kelimpahan gugus diol vicinal dalam struktur mereka. Ini pembelahan oksidatif, yang dikenal sebagai reaksi Malaprade sangat berguna untuk analisis derivatif O-tersubstitusi selektif saccharides, karena fungsi eter tidak bereaksi. Stoikiometri belahan dada aldohexose ditunjukkan dalam persamaan berikut.
Hoch 2 (CHOH) 4 CHO + 5 hio 4
|
- >
|
H 2 O + C = 5 HCO 2 H + 5 hio 3
|
Konfigurasi dari Glukosa
Keempat pusat kiral dalam glukosa mengindikasikan mungkin ada sebanyak enam belas (2 4 ) stereoisomer memiliki konstitusi ini. Ini akan ada sebagai delapan diastereomerik pasang enantiomer, dan tantangan awal adalah untuk menentukan yang mana dari delapan berhubungan dengan glukosa. Tantangan tersebut telah diterima dan bertemu pada tahun 1891 oleh kimiawan Jerman Emil Fischer .Negosiasi yang sukses dari labirin stereokimia disajikan oleh aldohexoses adalah tur logis de force, dan sudah sepatutnya bahwa ia menerima Hadiah Nobel 1902 untuk kimia untuk prestasi ini. Salah satu tugas pertama yang dihadapi oleh Fischer adalah untuk merancang sebuah metode yang mewakili konfigurasi setiap pusat kiral secara jelas. Untuk tujuan ini, ia menemukan teknik sederhana untuk menggambar rantai pusat kiral, yang sekarang kita sebut rumus proyeksi Fischer . Klik link ini untuk review.
Pada saat Fischer melakukan proyek glukosa itu tidak mungkin untuk menetapkan konfigurasi absolut dari suatu enantiomer. Akibatnya, Fischer membuat pilihan sewenang-wenang untuk (+)-glukosa dan membentuk jaringan konfigurasi aldosa terkait yang ia sebut D -keluarga. Gambar cermin dari konfigurasi ini kemudian ditunjuk L -keluarga aldoses. Untuk menggambarkan menggunakan pengetahuan hari ini, rumus proyeksi Fischer dan nama untuk keluarga D-aldosa (tiga sampai enam atom karbon) yang ditunjukkan di bawah ini, dengan atom karbon asimetrik (pusat kiral) berwarna merah. Pusat kiral terakhir dalam rantai aldosa (terjauh dari kelompok aldehida) dipilih oleh Fischer sebagai penanda situs D / L. Jika kelompok hidroksil dalam rumus proyeksi menunjuk ke kanan, itu didefinisikan sebagai anggota keluarga D-. Sebuah kelompok hidroksil kiri diarahkan (bayangan cermin) kemudian mewakili L-keluarga. Tugas awal Fischer dari konfigurasi D-memiliki peluang 50:50 yang benar, tetapi semua kesimpulan berikutnya nya mengenai konfigurasi relatif aldoses berbagai yang nyenyak berbasis. tahun 1951 x-ray fluoresensi studi (+)-tartrat asam , dilakukan di Belanda oleh Johannes Martin Bijvoet (diucapkan "buy kaki"), membuktikan bahwa pilihan Fischer adalah benar .
Adalah penting untuk mengenali bahwa tanda dari senyawa rotasi tertentu (jumlah percobaan) tidak berkorelasi dengan konfigurasi (D atau L). Ini adalah masalah sederhana untuk mengukur rotasi optik dengan polarimeter a. Menentukan konfigurasi mutlak biasanya membutuhkan interkonversi kimia dengan senyawa yang dikenal oleh jalur reaksi stereospesifik.
Keempat pusat kiral dalam glukosa mengindikasikan mungkin ada sebanyak enam belas (2 4 ) stereoisomer memiliki konstitusi ini. Ini akan ada sebagai delapan diastereomerik pasang enantiomer, dan tantangan awal adalah untuk menentukan yang mana dari delapan berhubungan dengan glukosa. Tantangan tersebut telah diterima dan bertemu pada tahun 1891 oleh kimiawan Jerman Emil Fischer .Negosiasi yang sukses dari labirin stereokimia disajikan oleh aldohexoses adalah tur logis de force, dan sudah sepatutnya bahwa ia menerima Hadiah Nobel 1902 untuk kimia untuk prestasi ini. Salah satu tugas pertama yang dihadapi oleh Fischer adalah untuk merancang sebuah metode yang mewakili konfigurasi setiap pusat kiral secara jelas. Untuk tujuan ini, ia menemukan teknik sederhana untuk menggambar rantai pusat kiral, yang sekarang kita sebut rumus proyeksi Fischer . Klik link ini untuk review.
Pada saat Fischer melakukan proyek glukosa itu tidak mungkin untuk menetapkan konfigurasi absolut dari suatu enantiomer. Akibatnya, Fischer membuat pilihan sewenang-wenang untuk (+)-glukosa dan membentuk jaringan konfigurasi aldosa terkait yang ia sebut D -keluarga. Gambar cermin dari konfigurasi ini kemudian ditunjuk L -keluarga aldoses. Untuk menggambarkan menggunakan pengetahuan hari ini, rumus proyeksi Fischer dan nama untuk keluarga D-aldosa (tiga sampai enam atom karbon) yang ditunjukkan di bawah ini, dengan atom karbon asimetrik (pusat kiral) berwarna merah. Pusat kiral terakhir dalam rantai aldosa (terjauh dari kelompok aldehida) dipilih oleh Fischer sebagai penanda situs D / L. Jika kelompok hidroksil dalam rumus proyeksi menunjuk ke kanan, itu didefinisikan sebagai anggota keluarga D-. Sebuah kelompok hidroksil kiri diarahkan (bayangan cermin) kemudian mewakili L-keluarga. Tugas awal Fischer dari konfigurasi D-memiliki peluang 50:50 yang benar, tetapi semua kesimpulan berikutnya nya mengenai konfigurasi relatif aldoses berbagai yang nyenyak berbasis. tahun 1951 x-ray fluoresensi studi (+)-tartrat asam , dilakukan di Belanda oleh Johannes Martin Bijvoet (diucapkan "buy kaki"), membuktikan bahwa pilihan Fischer adalah benar .
Adalah penting untuk mengenali bahwa tanda dari senyawa rotasi tertentu (jumlah percobaan) tidak berkorelasi dengan konfigurasi (D atau L). Ini adalah masalah sederhana untuk mengukur rotasi optik dengan polarimeter a. Menentukan konfigurasi mutlak biasanya membutuhkan interkonversi kimia dengan senyawa yang dikenal oleh jalur reaksi stereospesifik.
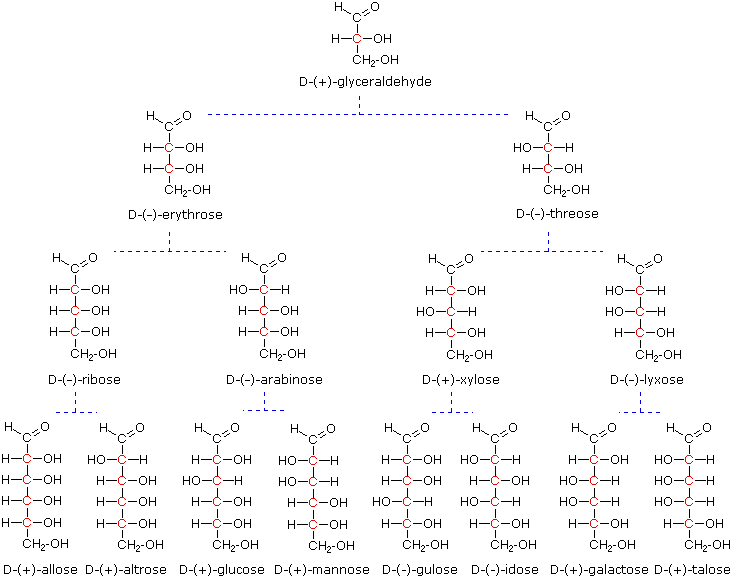
Model dari aldoses perwakilan dapat diperiksa dengan mengklik pada rumus Fischer untuk gliseraldehida, erythrose, threose, ribosa, arabinosa, allose, altrose, glukosa atau manosa dalam diagram di atas.
2. Penting
Reaksi
Emil Fischer
memanfaatkan reaksi beberapa kunci dalam program studi karbohidrat nya. Ini dijelaskan di sini, bersama-sama
dengan informasi yang masing-masing memberikan.Oksidasi
Seperti disebutkan di atas , gula dapat diklasifikasikan sebagai mengurangi atau non-mengurangi berdasarkan reaktivitas mereka dengan 'Tollens, Benediktus atau reagen Fehling . Jika gula teroksidasi oleh reagen itu disebut mengurangi , karena oksidan (Ag (+) atau Cu (+2) ) berkurang dalam reaksi, yang dibuktikan dengan pembentukan cermin perak atau pengendapan oksida cuprous. Tes Tollens 'umumnya digunakan untuk mendeteksi fungsi aldehida, dan karena facile interkonversi ketoses dan aldoses bawah kondisi dasar dari tes ini, ketoses seperti fruktosa juga bereaksi dan diklasifikasikan sebagai mengurangi gula.
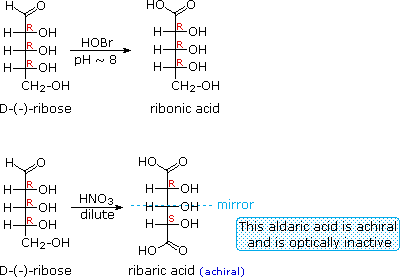
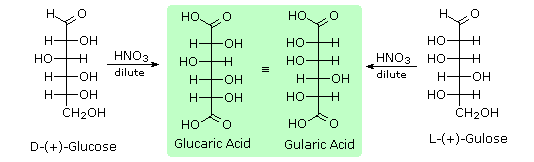
Ketika fungsi aldehida dari aldosa suatu dioksidasi menjadi asam karboksilat produk disebut asam aldonat . Karena 2 fungsi hidroksil º yang juga hadir dalam senyawa ini, agen pengoksidasi ringan seperti hipobromit harus digunakan untuk konversi ini (persamaan 1). Jika kedua ujung rantai aldosa yang teroksidasi menjadi asam karboksilat produk disebut asam aldaric . Dengan mengkonversi aldosa untuk turunan asam yang sesuai aldaric nya, ujung-ujung rantai menjadi identik (ini juga dapat dicapai dengan mengurangi aldehida untuk CH 2 OH, seperti yang tercantum di bawah). Operasi semacam itu akan mengungkapkan setiap simetri laten dalam molekul tersisa. Dengan demikian, ribosa, xilosa, allose dan galaktosa menghasilkan asam aldaric akiral yang, tentu saja, tidak optik aktif. Oksidasi ribosa ditunjukkan dalam persamaan 2 di bawah ini.
1. |
 |
2.
|
|
3.
|
 |
Pengurangan
Sodium borohidrida pengurangan aldosa yang membuat ujung dihasilkan alditol rantai identik, Hoch 2 (CHOH) n CH 2 OH, dengan demikian mencapai perubahan konfigurasional yang sama yang dihasilkan oleh oksidasi asam aldaric. Dengan demikian, allitol dan galactitol dari pengurangan allose dan galaktosa yang akiral, dan altrose dan talose dikurangi dengan alditol kiral yang sama. Ringkasan reaksi redoks, dan nomenklatur derivatif diberikan pada tabel berikut.
Sodium borohidrida pengurangan aldosa yang membuat ujung dihasilkan alditol rantai identik, Hoch 2 (CHOH) n CH 2 OH, dengan demikian mencapai perubahan konfigurasional yang sama yang dihasilkan oleh oksidasi asam aldaric. Dengan demikian, allitol dan galactitol dari pengurangan allose dan galaktosa yang akiral, dan altrose dan talose dikurangi dengan alditol kiral yang sama. Ringkasan reaksi redoks, dan nomenklatur derivatif diberikan pada tabel berikut.
Derivatif dari Hoch 2 (CHOH) n CHO
|
||
HOBr
Oksidasi
|
- >
|
Hoch 2 (CHOH) n CO 2 H
an Asam aldonat |
HNO 3 Oksidasi
|
- >
|
H 2 OC (CHOH) n CO 2 H
an Asam Aldaric |
NaBH 4 Pengurangan
|
- >
|
Hoch 2 (CHOH) n CH 2 OH
Alditol suatu |
1.
|
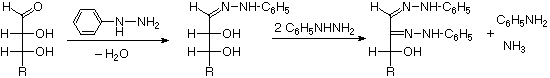 |
2.
|
|
Memperpendek dan Perpanjangan
Rantai
1.
|
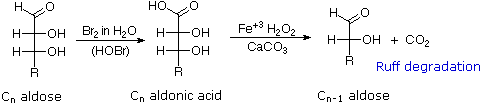 |
2.
|
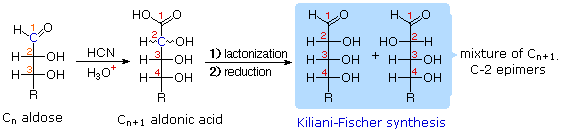
|
Menggunakan reaksi kita sekarang dapat mengikuti kereta Fischer logika dalam menentukan konfigurasi D-glukosa.
1.
Ribose dan arabinosa (dua pentosa terkenal) keduanya memberikan erythrose
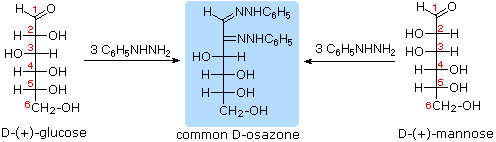
tentang degradasi Ruff.
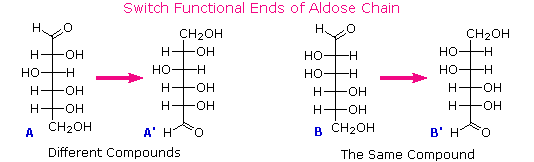
Seperti yang diharapkan, Kiliani-Fischer sintesis diterapkan erythrose memberikan campuran ribosa dan arabinosa. 2. Oksidasi erythrose memberikan asam (optik aktif) akiral aldaric . Ini mendefinisikan konfigurasi erythrose. 3. Oksidasi ribosa memberikan asam (optik aktif) akiral aldaric. Ini mendefinisikan konfigurasi dari kedua ribosa dan arabinosa. 4. pemendekan Ruff glukosa memberikan arabinosa, dan Kiliani-Fischer sintesis diterapkan untuk arabinosa memberikan campuran glukosa dan mannose. 5. Glukosa dan mannose karena itu epimer di C-2, fakta dikonfirmasi oleh produk umum dari reaksi osazon mereka. 6. Sepasang struktur untuk ini epimer dapat ditulis, tetapi yang glukosa dan yang mannose?
Dalam
rangka untuk menentukan mana yang epimer adalah glukosa, Fischer membuat
penggunaan melekat C 2 simetri dalam
empat inti-karbon dissymmetric satu epimer ( B ). Hal
ini ditunjukkan dalam diagram berikut dengan titik merah di mana sumbu simetri
melewati rumus proyeksi. Karena
simetri ini, jika aldehida dan 1 º-alkohol fungsi di ujung rantai
dipertukarkan, epimer B akan berubah, sedangkan A. akan
diubah menjadi senyawa yang berbeda Dengan
mengklik pada diagram ,
konsekuensi seperti pertukaran akan ditampilkan.Seperti yang diharapkan, Kiliani-Fischer sintesis diterapkan erythrose memberikan campuran ribosa dan arabinosa. 2. Oksidasi erythrose memberikan asam (optik aktif) akiral aldaric . Ini mendefinisikan konfigurasi erythrose. 3. Oksidasi ribosa memberikan asam (optik aktif) akiral aldaric. Ini mendefinisikan konfigurasi dari kedua ribosa dan arabinosa. 4. pemendekan Ruff glukosa memberikan arabinosa, dan Kiliani-Fischer sintesis diterapkan untuk arabinosa memberikan campuran glukosa dan mannose. 5. Glukosa dan mannose karena itu epimer di C-2, fakta dikonfirmasi oleh produk umum dari reaksi osazon mereka. 6. Sepasang struktur untuk ini epimer dapat ditulis, tetapi yang glukosa dan yang mannose?
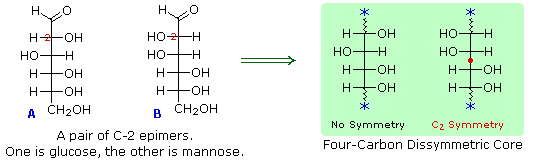
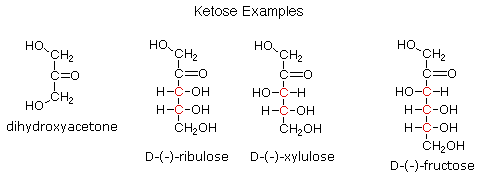
3. Ketoses
Jika monosakarida
memiliki fungsi karbonil pada salah satu atom bagian dalam rantai karbon itu
diklasifikasikan sebagai ketose . Dihydroxyacetone
tidak mungkin gula, tetapi dimasukkan sebagai analog ketose dari
gliseraldehida. Gugus karbonil
umumnya ditemukan di C-2, seperti yang digambarkan oleh contoh-contoh berikut
(pusat kiral yang berwarna merah). Seperti
yang diharapkan, fungsi karbonil dari ketose yang dapat dikurangi dengan
natrium borohidrida, biasanya untuk campuran produk epimeric. D-Fruktosa, paling manis dari gula
alami yang umum, misalnya adalah dikurangi menjadi campuran D-glucitol
(sorbitol) dan D-manitol, dinamai aldohexoses dari mana mereka juga dapat
diperoleh dengan reduksi analog. Manitol
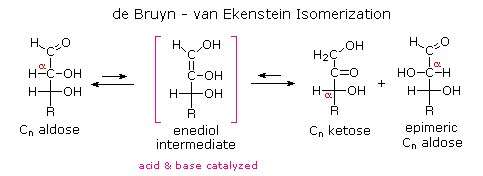
sendiri merupakan karbohidrat alami yang umum. Meskipun ketoses adalah isomer yang berbeda dari monosakarida aldosa, kimia kedua kelas ini terkait karena interkonversi facile mereka di hadapan asam atau katalis basa. Ini interkonversi, dan epimerization yang sesuai pada alpha situs untuk fungsi karbonil, terjadi dengan cara yang enediol tautomerik menengah. Dengan mengklik pada diagram , persamaan yang menggambarkan ini isomerizations akan ditampilkan.
4. Anomeric
Bentuk Glukosa
Penjelasan brilian
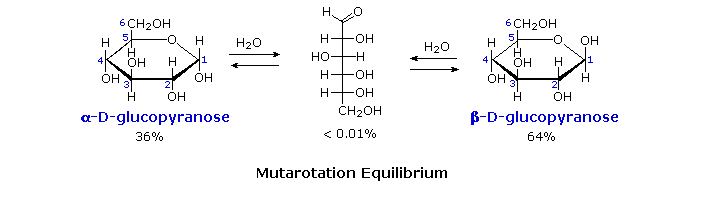
Fischer dari konfigurasi glukosa tidak menghapus semua ketidakpastian mengenai
strukturnya. Dua bentuk kristal
yang berbeda dari glukosa yang dilaporkan pada tahun 1895. Masing-masing memberikan semua reaksi
karakteristik glukosa, dan bila dilarutkan dalam air disetimbangkan dengan
campuran yang sama. Equilibrium
ini berlangsung selama beberapa menit, dan perubahan aktivitas optik yang
terjadi disebut mutarotation . Fakta-fakta
ini dirangkum dalam diagram di bawah ini.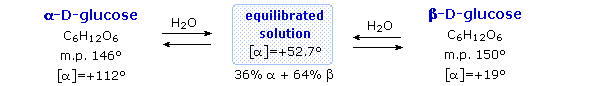
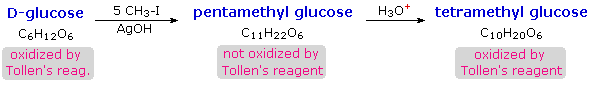
Pencarian kebenaran ilmiah sering berlangsung secara bertahap, dan penjelasan struktural glukosa berfungsi sebagai contoh yang baik. Ini harus jelas dari bukti baru yang disajikan di atas, bahwa struktur rantai terbuka pentahydroxyhexanal ditarik di atas harus diubah. Entah bagaimana pusat stereogenik baru harus diciptakan, dan aldehida harus dinonaktifkan dalam turunan pentamethyl. Sebuah solusi sederhana untuk dilema ini dicapai dengan mengubah struktur aldehida terbuka untuk glukosa menjadi hemiacetal siklik, disebut glukopiranosa , seperti yang ditunjukkan dalam diagram berikut. Aldehid linier berujung pada sisinya, dan rotasi tentang ikatan C4-C5 membawa fungsi C5-hidroksil dekat dengan karbon aldehida. Untuk memudahkan melihat, enam-beranggota hemiacetal struktur digambar sebagai sebuah segi enam datar, tetapi sebenarnya mengasumsikan konformasi kursi. The hemiacetal atom karbon (C-1) menjadi pusat stereogenik baru, sering disebut sebagai karbon anomeric , dan α dan β-isomer disebut anomers .
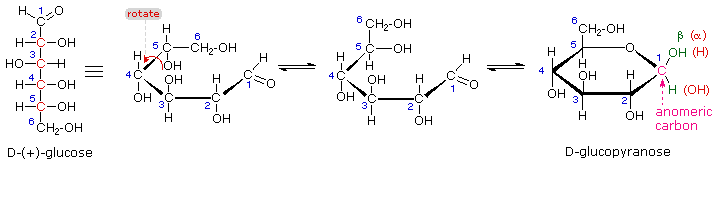
Kita sekarang dapat mempertimbangkan bagaimana ini modifikasi dari rekening glukosa struktur untuk fakta membingungkan disebutkan di atas. Pertama, kita tahu bahwa HEMIASETAL berada dalam kesetimbangan dengan karbonil dan komponen alkohol saat dalam larutan. Akibatnya, solusi segar baik kristal alpha atau beta-glukosa dalam air harus membentuk sebuah campuran kesetimbangan dari kedua anomers, ditambah bentuk rantai terbuka rantai. Ini akan ditampilkan di atas dengan mengklik pada diagram . Perhatikan bahwa meskipun konsentrasi yang sangat rendah dari aldehida rantai terbuka dalam campuran ini, reaksi kimia khas aldehida berlangsung cepat.
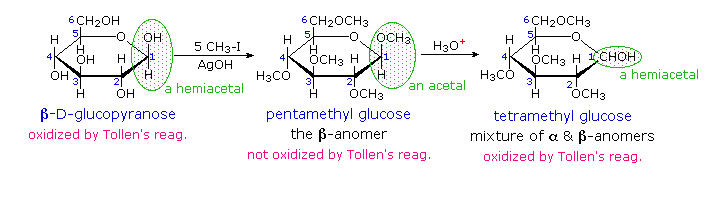
Kedua, turunan eter pentamethyl dari struktur pyranose mengubah fungsi hemiacetal ke asetal. asetal stabil ke basis , sehingga produk ini tidak boleh bereaksi dengan reagen tollen atau dikurangi dengan natrium borohidrida. Asam hidrolisis asetal meregenerasi komponen karbonil dan alkohol, dan dalam kasus turunan glukosa ini akan menjadi eter tetrametil dari hemiacetal pyranose. Senyawa ini akan, tentu saja, mengalami reaksi aldehida yang khas. Dengan mengklik pada diagram kedua kalinya hubungan ini akan ditampilkan di atas.
5. Siklik
Bentuk Monosakarida
Seperti disebutkan di atas, bentuk struktur
disukai banyak monosakarida mungkin bahwa dari hemiacetal siklik. Lima dan enam-beranggota cincin yang
disukai dibanding ukuran cincin lain karena rendah sudut dan gerhana ketegangan . Struktur
siklik semacam ini diistilahkan furanose (beranggota lima) atau pyranose (enam-beranggota), mencerminkan hubungan
ukuran cincin dengan senyawa heterosiklik umum furan dan pyran ditampilkan di
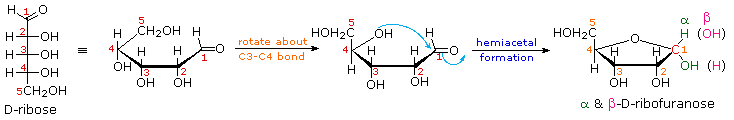
sebelah kanan. Ribosa, sebuah
aldopentose penting, biasanya mengadopsi struktur furanose, seperti yang
ditunjukkan pada gambar berikut. Dengan
konvensi untuk keluarga D-, yang beranggota lima cincin furanose digambarkan
dalam proyeksi edgewise dengan oksigen cincin ditempatkan jauh dari penampil. Atom karbon anomeric (berwarna merah
di sini) ditempatkan di sebelah kanan. Ikatan
atas untuk karbon ini didefinisikan sebagai beta, obligasi lebih rendah maka
adalah alpha . Klik pada diagram berikut untuk melihat model β-D-ribofuranose .
Bentuk pyranose siklik monosakarida dari berbagai sering ditarik dalam proyeksi datar dikenal sebagai rumus Haworth , setelah ahli kimia Inggris, Norman Haworth . Seperti cincin furanose, karbon anomeric ditempatkan di sebelah kanan dengan oksigen cincin ke belakang pandangan edgewise. Dalam keluarga D-, obligasi alpha dan beta memiliki orientasi yang sama ditetapkan untuk cincin furanose (beta terserah & alpha turun). Formula ini Haworth nyaman untuk menampilkan hubungan stereokimia, namun tidak mewakili bentuk sebenarnya dari molekul. Kita tahu bahwa molekul ini sebenarnya berkerut dengan cara kita sebut konformasi kursi . Contoh empat struktur pyranose khas ditunjukkan di bawah ini, baik sebagai proyeksi Haworth dan sebagai konformer lebih representatif kursi. Para karbon anomeric yang berwarna merah.
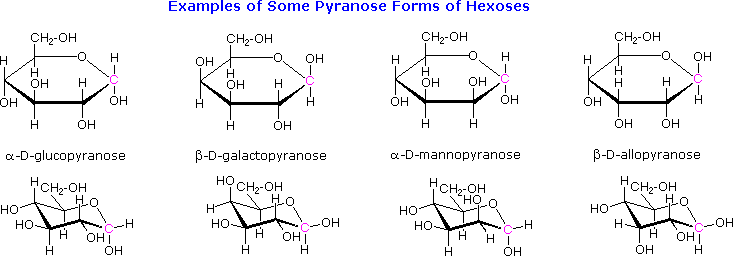
Model ini glukosa, galaktosa, struktur pyranose mannose dan allose dapat dilihat oleh Mengklik Disini .Halaman praktek untuk memeriksa konfigurasi aldohexoses dapat dilihat oleh Mengklik Disini .
Ukuran cincin hemiacetal siklik diadopsi oleh gula yang diberikan
tidak konstan, tetapi dapat bervariasi dengan substituen dan fitur struktural
lainnya. Aldolhexoses biasanya
membentuk cincin pyranose dan homolognya pentosa mereka cenderung memilih
bentuk furanose, tetapi ada contoh kontra banyak. Pembentukan asetal derivatif
menggambarkan bagaimana perubahan halus dapat mengubah selektivitas ini. Dengan mengklik pada diagram di
atas . layar akan berubah untuk menggambarkan
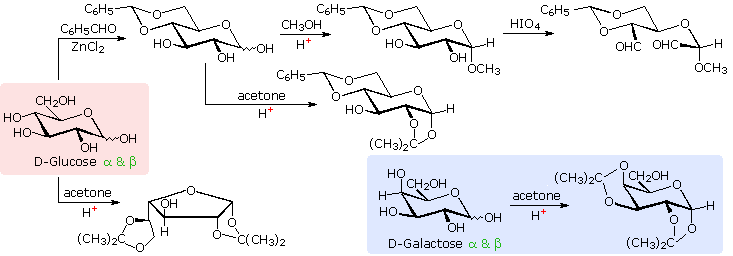
hal ini. Struktur pyranose untuk D-glukosa
digambarkan dalam kotak mawar-berbayang di sebelah kiri. Derivatif asetal telah disusun oleh
asam-katalis reaksi dengan benzaldehida dan aseton. Sebagai aturan, bentuk benzaldehida
beranggota enam asetal siklik, sedangkan aseton lebih memilih untuk membentuk
beranggota lima asetal. Persamaan
atas menunjukkan pembentukan dan beberapa reaksi dari 4,6-O-benzylidene asetal,
sebuah kelompok pelindung umum digunakan. Sebuah
glikosida metil turunan dari senyawa ini (lihat di bawah) meninggalkan C-2 dan
C-3 kelompok hidroksil terkena reaksi seperti pembelahan asam periodik,
ditampilkan sebagai langkah terakhir. Pembentukan
asetal isopropylidene di C-1 dan C-2, pusat struktur, meninggalkan C-3
hidroksil sebagai satu-satunya fungsi terlindungi. Oksidasi selektif untuk keton kemudian
mungkin. Akhirnya, langsung
di-O-isopropylidene derivatisasi glukosa melalui reaksi dengan hasil aseton
kelebihan dalam perubahan struktur furanose di mana C-3 hidroksil lagi
terlindungi. Namun, reaksi yang
sama dengan D-galaktosa, ditampilkan dalam kotak biru-berbayang, menghasilkan
produk pyranose di mana C-6 hidroksil tidak dilindungi. Kedua derivatif tidak bereaksi dengan
reagen Tollens '. Perbedaan
perilaku dikaitkan dengan orientasi cis-dari C-3 dan C-4 gugus hidroksil di galaktosa,
yang memungkinkan pembentukan beranggota lima kurang tegang siklik asetal,
dibandingkan dengan trans-C-3 dan C-4 hidroksil kelompok glukosa. Derivatizations semacam ini
memungkinkan reaksi selektif akan dilakukan di lokasi yang berbeda dalam molekul-molekul
yang sangat difungsikan.
6. Glikosida
Derivatif asetal
terbentuk ketika monosakarida bereaksi dengan alkohol dalam adanya katalis asam
disebut glikosida . Reaksi
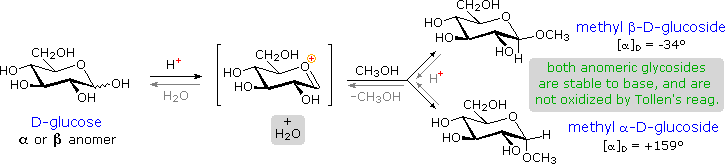
ini digambarkan untuk glukosa dan metanol dalam diagram di bawah ini. Dalam penamaan glikosida, yang
"ose" akhiran nama gula diganti dengan "oside", dan nama
grup alkohol ditempatkan pertama. Seperti
umumnya benar untuk sebagian asetal ,
pembentukan glikosida melibatkan hilangnya setara dengan air. Produk Diether stabil ke dasar dan
oksidan alkali seperti reagen tollen itu. Karena
asam-katalis aldolization adalah reversibel, glikosida dapat dihidrolisis
kembali ke alkohol dan komponen gula oleh asam berair. The glucosides metil anomeric terbentuk dalam rasio keseimbangan alpha 66% sampai 34% beta. Dari struktur dalam diagram sebelumnya, kita melihat bahwa pyranose cincin lebih konformasi kursi di mana jumlah terbesar dari substituen yang khatulistiwa. Dalam kasus glukosa, substituen pada anomer beta-semua khatulistiwa, sedangkan substituen-1 C dalam alpha-anomer perubahan aksial. Karena substituen pada cincin sikloheksana lebih memilih lokasi khatulistiwa selama aksial (methoxycyclohexane adalah 75% khatulistiwa), preferensi untuk alpha-glycopyranoside formasi yang tak terduga, dan disebut sebagai efek anomeric .
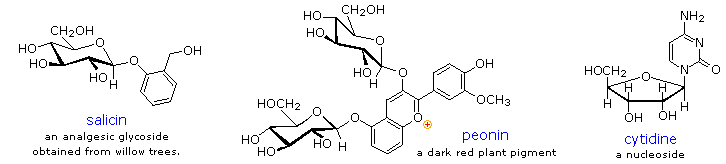
Glikosida berlimpah dalam sistem biologi. Dengan melampirkan bagian gula ke struktur lipid atau benzenoid, kelarutan dan sifat lainnya dari senyawa dapat berubah secara substansial. Karena pengaruh memodifikasi penting derivatisasi tersebut, banyak sistem enzim, yang dikenal sebagai glycosidases, telah berevolusi untuk lampiran dan penghapusan gula dari alkohol, fenol dan amina. Kimiawan mengacu pada komponen gula dari glikosida alam sebagai glycon dan komponen alkohol sebagai aglycon . Dua contoh glikosida alami dan salah satu contoh dari turunan amino akan ditampilkan di atas dengan mengklik pada diagram . Salisin, salah satu obat herbal tertua yang dikenal, adalah model untuk aspirin analgesik sintetik. Sebuah kelas besar dihidroksilasi, kation oksonium aromatik yang disebutanthocyanin menyediakan, warna merah ungu dan biru banyak bunga, buah-buahan dan beberapa sayuran. Peonin adalah salah satu contoh dari kelas ini pigmen alami, yang menunjukkan ketergantungan pH warna diucapkan. Gugus oksonium hanya stabil pada lingkungan asam, dan warna berubah atau menghilang ketika basa ditambahkan. Perubahan yang kompleks yang terjadi ketika anggur difermentasi dan disimpan di bagian yang berhubungan dengan glikosida dari anthocyanin. Akhirnya, turunan amino dari ribosa, seperti cytidine memainkan peran penting dalam agen phosphorylating biologi, koenzim dan transportasi informasi dan bahan penyimpanan.
7. Disakarida
Ketika komponen
alkohol glikosida yang disediakan oleh fungsi hidroksil pada monosakarida lain,
senyawa ini disebut disakarida . Empat
contoh disakarida terdiri dari dua unit glukosa ditunjukkan pada diagram
berikut. Cincin glukopiranosa
individu diberi label A dan B, dan ikatan glikosida dilingkari warna biru muda. Perhatikan bahwa ikatan glikosida
mungkin alpha, seperti di maltosa dan trehalosa, atau beta seperti di selobiosa
dan gentiobiose. Asam-katalis
hidrolisis tersebut glukosa menghasilkan disakarida sebagai satu-satunya
produk. Enzim-katalis hidrolisis
selektif untuk ikatan glikosida yang spesifik, sehingga alpha-glikosidase
memotong maltosa dan trehalosa menjadi glukosa, tetapi tidak membelah selobiosa
atau gentiobiose. Sebuah
beta-glikosidase memiliki aktivitas yang berlawanan. Dalam rangka untuk menarik struktur representatif untuk selobiosa, salah satu cincin glukopiranosa harus diputar oleh 180 º, namun fitur ini sering diabaikan demi mempertahankan perspektif yang biasa untuk cincin individu. Ikatan antara cincin glukopiranosa di selobiosa dan maltosa adalah dari karbon anomeric dalam cincin A ke kelompok C-4 hidroksil pada cincin B. Ini meninggalkan karbon anomeric di ring B gratis, jadi selobiosa dan maltosa keduanya mungkin menganggap alpha dan beta anomers di situs tersebut (bentuk beta ditunjukkan dalam diagram). Gentiobiose memiliki link beta-glikosida, yang berasal di C-1 di cincin A dan berakhir pada C-6 di ring B. Its alpha-anomer digambarkan dalam diagram. Karena selobiosa, maltosa dan gentiobiose adalah HEMIASETAL mereka semua gula-gula pereduksi (teroksidasi oleh reagen tollen s). Trehalosa, disakarida ditemukan dalam jamur tertentu, adalah bis-asetal, dan karena itu gula non-pereduksi. Sebuah nomenklatur sistematis untuk disakarida ada, tetapi sebagai contoh berikut menggambarkan, ini sering panjang.
Selobiosa :
4-O-β-D-Glucopyranosyl-D-glukosa (beta-anomer digambar) Maltose : 4-O-α-D-Glucopyranosyl-D-glukosa
(beta-anomer digambar) Gentiobiose : 6 - O-β-D-Glucopyranosyl-D-glukosa
(alpha-anomer digambar) trehalosa :
α-D-Glucopyranosyl-α-D-glucopyranoside
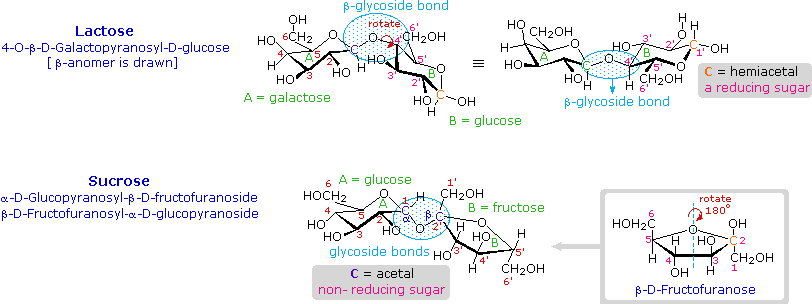
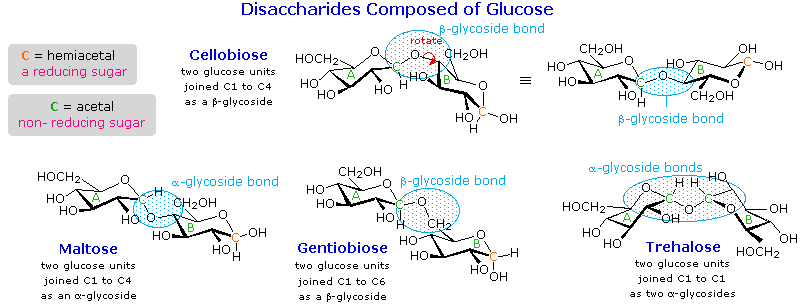
Meskipun semua disakarida ditampilkan di sini terdiri dari dua cincin glukopiranosa, sifat mereka berbeda dalam cara yang menarik. Maltosa, kadang-kadang disebut gula malt, berasal dari hidrolisis pati. Ini adalah sekitar sepertiga semanis tebu (sukrosa), mudah dicerna oleh manusia, dan difermentasi oleh ragi. Selobiosa diperoleh oleh hidrolisis selulosa. Ini memiliki hampir tidak ada rasa, yang dicerna oleh manusia, dan tidak difermentasi oleh ragi. Beberapa bakteri memiliki beta-glukosidase enzim yang menghidrolisis ikatan glikosidik di selobiosa dan selulosa. Keberadaan bakteri tersebut dalam saluran pencernaan sapi dan rayap memungkinkan hewan-hewan untuk menggunakan selulosa sebagai makanan. Akhirnya, dapat dicatat bahwa trehalosa memiliki rasa manis jelas, namun gentiobiose pahit.
Disakarida terdiri dari gula lain yang diketahui, tetapi glukosa sering salah satu komponen. Dua contoh penting dari disakarida campuran tersebut akan ditampilkan di atas dengan mengklik pada diagram .Laktosa, juga dikenal sebagai gula susu, adalah senyawa galaktosa-glukosa bergabung sebagai glikosida beta-. Ini adalah gula pereduksi karena fungsi hemiacetal tersisa di bagian glukosa. Banyak orang dewasa, terutama mereka yang berasal dari daerah-daerah di mana susu bukanlah makanan pokok, memiliki intoleransi laktosa untuk metabolisme. Bayi memiliki enzim pencernaan yang memotong ikatan beta-glikosida di laktosa, tetapi produksi enzim ini berhenti dengan penyapihan. Keju kurang tunduk pada masalah intoleransi laktosa, karena sebagian besar laktosa akan dihapus dengan air dadih. Sukrosa, atau gula tebu, adalah agen pemanis yang paling umum digunakan kami. Ini adalah disakarida tak-mereduksi terdiri dari glukosa dan fruktosa bergabung pada karbon anomeric masing-masing oleh ikatan glikosida (satu alpha dan beta satu). Dalam rumus ditampilkan di sini cincin fruktosa telah diputar 180 º dari perspektif konvensional.
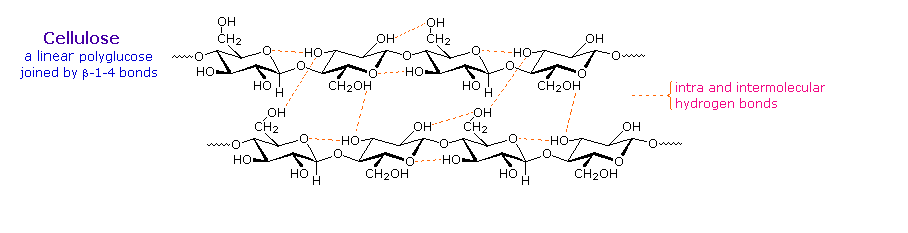
8. Polisakarida
Seperti namanya,
polisakarida adalah molekul berat badan tinggi besar-molekul dibangun dengan
bergabung unit monosakarida bersama oleh obligasi glikosidik. Mereka kadang-kadang disebut glycans .Senyawa yang paling penting dalam hal ini,
selulosa pati kelas, dan glikogen semua polimer glukosa. Hal ini dapat dijelaskan dengan
asam-katalis hidrolisis untuk monosakarida tersebut. Sejak hidrolisis parsial selulosa
memberikan jumlah yang bervariasi dari selobiosa, kami menyimpulkan unit
glukosa dalam makromolekul ini bergabung dengan beta-glikosida ikatan antara
C-1 dan C-4 situs gula yang berdekatan. Hidrolisis
parsial pati dan glikogen menghasilkan maltosa disakarida bersama-sama dengan
rendah dekstran berat molekul, polisakarida di mana molekul glukosa bergabung
dengan alpha-glikosida hubungan antara C-1 dan C-6, serta alpha C-1 ke C-4 Link
yang ditemukan di maltosa. Polisakarida
dibangun dari monosakarida lain (misalnya mannose, galaktosa, xilosa dan
arabinosa) juga dikenal, tetapi tidak akan dibahas di sini.Lebih dari setengah dari total karbon organik di biosfer bumi dalam selulosa . Serat kapas selulosa pada dasarnya murni, dan kayu dari semak-semak dan pohon adalah sekitar 50% selulosa. Sebagai polimer glukosa, selulosa memiliki rumus (C 6 H 10 O 5 ) n dimana n berkisar dari 500 sampai 5.000, tergantung pada sumber dari polimer. Unit glukosa dalam selulosa terhubung secara linear, seperti yang ditunjukkan pada gambar di bawah. Beta-glikosida obligasi memungkinkan rantai ini untuk meregangkan, dan konformasi ini distabilkan oleh ikatan hidrogen intramolekul. Sebuah orientasi paralel rantai yang berdekatan juga disukai oleh ikatan hidrogen antarmolekul. Meskipun individu ikatan hidrogen relatif lemah, obligasi tersebut banyak bertindak bersama-sama dapat memberikan stabilitas besar untuk konformasi tertentu molekul besar. Sebagian besar hewan tidak dapat mencerna selulosa sebagai makanan, dan dalam diet manusia ini bagian dari fungsi sayuran asupan sebagai serat dan dihilangkan sebagian besar tidak berubah. Beberapa hewan (sapi dan rayap, misalnya) mikroorganisme pelabuhan usus bahwa kerusakan selulosa menjadi monosakarida nutrisi dengan menggunakan beta-glikosidase enzim.
Selulosa umumnya disertai dengan berat molekul yang lebih rendah, bercabang, polimer amorf disebut hemiselulosa . Berbeda dengan selulosa, hemiselulosa secara struktural lemah dan mudah dihidrolisis oleh asam encer atau basa. Juga, banyak enzim mengkatalisis hidrolisis tersebut. Hemiselulosa terdiri dari banyak D-pentosa gula, dengan xilosa menjadi komponen utama. Asam mannose dan mannuronic sering hadir, serta galaktosa dan asam galacturonic.
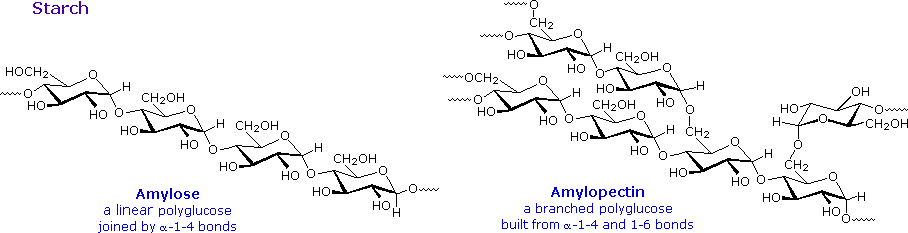
Pati merupakan polimer dari glukosa, ditemukan di akar, rimpang, biji, batang, umbi-umbian dan umbi tanaman, seperti butiran mikroskopis yang memiliki bentuk karakteristik dan ukuran. Sebagian besar hewan, termasuk manusia, bergantung pada para pati tanaman untuk makanan. Struktur pati yang lebih kompleks daripada selulosa. Granul utuh tidak larut dalam air dingin, tapi grinding atau bengkak dalam air hangat menyebabkan mereka meledak.
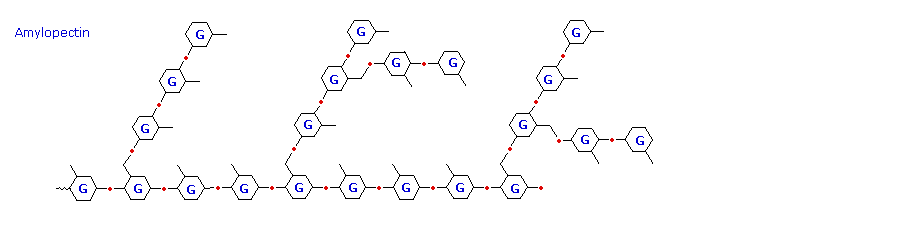
The pati dirilis terdiri dari dua fraksi. Sekitar 20% adalah bahan larut dalam air disebut amilosa . Molekul amilosa adalah rantai linear dari beberapa ribu unit glukosa bergabung dengan alpha C-1 sampai C-4 obligasi glikosida. Solusi amilosa sebenarnya dispersi dari misel heliks terhidrasi. Mayoritas pati adalah zat berat molekul yang lebih tinggi, yang terdiri dari hampir satu juta unit glukosa, dan disebutamilopektin . Molekul amilopektin adalah jaringan bercabang dibangun dari C-1 sampai C-4 dan C-1 sampai C-6 link glikosida, dan pada dasarnya tidak larut air. Rumus struktur representatif untuk amilosa dan amilopektin akan ditampilkan di atas dengan mengklik pada diagram . Untuk melihat struktur diperluas untuk amilopektin klik lagi pada diagram. Percabangan dalam diagram ini berlebihan, karena rata-rata, cabang hanya terjadi setiap dua puluh lima unit glukosa.
Hidrolisis pati, biasanya dengan reaksi enzimatik, menghasilkan cairan manis sebagian besar terdiri dari glukosa. Bila tepung jagung merupakan bahan baku, produk ini dikenal sebagai sirup jagung . Hal ini banyak digunakan untuk melembutkan tekstur, menambah volume, melarang kristalisasi dan meningkatkan rasa makanan.
Glikogen adalah penyimpanan glukosa polimer yang digunakan oleh hewan. Ia memiliki struktur yang mirip dengan amilopektin, tetapi bahkan lebih bercabang (sekitar setiap unit glukosa kesepuluh). Tingkat percabangan dalam polisakarida dapat diukur dengan analisis enzimatik atau kimia.
Modifikasi sintetis Selulosa
Cotton, mungkin serat alam yang paling berguna, adalah selulosa hampir murni. Pembuatan tekstil dari katun melibatkan manipulasi fisik dari bahan baku dengan carding, menyisir dan berputar serat yang dipilih. Untuk kain kapas terbaik memiliki serat panjang, dan serat pendek atau debu kapas dihapus. Selulosa mentah juga tersedia dari pulp kayu dengan melarutkan matriks lignan sekitarnya. Sumber-sumber selulosa kurang diminati secara luas digunakan untuk membuat kertas.
Dalam rangka memperluas cara di mana selulosa dapat dimanfaatkan dengan praktis, ahli kimia telah menemukan teknik untuk mempersiapkan solusi dari turunan selulosa yang dapat dipintal menjadi serat, menyebar ke film atau dilemparkan dalam bentuk padat berbagai. Faktor kunci dalam transformasi ini adalah tiga kelompok hidroksil bebas pada setiap unit glukosa dalam rantai selulosa, - [C 6 H 7 O (OH) 3] n -. Esterifikasi fungsi ini menyebabkan produk polimer yang memiliki sifat yang sangat berbeda dibandingkan dengan selulosa sendiri.
Cotton, mungkin serat alam yang paling berguna, adalah selulosa hampir murni. Pembuatan tekstil dari katun melibatkan manipulasi fisik dari bahan baku dengan carding, menyisir dan berputar serat yang dipilih. Untuk kain kapas terbaik memiliki serat panjang, dan serat pendek atau debu kapas dihapus. Selulosa mentah juga tersedia dari pulp kayu dengan melarutkan matriks lignan sekitarnya. Sumber-sumber selulosa kurang diminati secara luas digunakan untuk membuat kertas.
Dalam rangka memperluas cara di mana selulosa dapat dimanfaatkan dengan praktis, ahli kimia telah menemukan teknik untuk mempersiapkan solusi dari turunan selulosa yang dapat dipintal menjadi serat, menyebar ke film atau dilemparkan dalam bentuk padat berbagai. Faktor kunci dalam transformasi ini adalah tiga kelompok hidroksil bebas pada setiap unit glukosa dalam rantai selulosa, - [C 6 H 7 O (OH) 3] n -. Esterifikasi fungsi ini menyebabkan produk polimer yang memiliki sifat yang sangat berbeda dibandingkan dengan selulosa sendiri.
Selulosa Nitrat , pertama
disiapkan lebih dari 150 tahun yang lalu dengan memperlakukan selulosa dengan
asam nitrat, adalah polimer sintetik awal untuk melihat penggunaan umum. Senyawa penuh nitrasi, - [C 6 H 7 O (ONO 2 ) 3 ] n -, yang disebut guncotton, adalah eksplosif
mudah terbakar dan merupakan komponen bubuk tanpa asap. Selulosa sebagian nitrasi disebut pyroxylin . Pyroxylin
larut dalam eter dan pada satu waktu yang digunakan untuk film fotografi dan
lak. Mudah terbakar tinggi
pyroxylin menyebabkan banyak kebakaran tragis bioskop selama periode
penggunaan. Selanjutnya,
hidrolisis lambat asam nitrat hasil pyroxylin, sebuah proses yang memberikan
kontribusi pada penurunan film film awal dalam penyimpanan. Selulosa Asetat , - [C 6 H 7 O (OAc) 3 ] n -, kurang mudah terbakar dibandingkan
pyroxylin , dan telah diganti dalam sebagian besar aplikasi. Hal ini dibuat dengan reaksi selulosa
dengan anhidrida asetat dan katalis asam. Sifat-sifat
produk bervariasi dengan tingkat asetilasi. Beberapa
memperpendek rantai terjadi terhindarkan dalam persiapan. Sebuah solusi aseton selulosa asetat
dapat dipaksa melalui spinneret untuk menghasilkan filamen, yang disebutrayon
asetat , yang dapat ditenun
menjadi kain. Rayon Viscose , yang disiapkan oleh pembentukan
turunan xantat alkali larut yang dapat dipintal menjadi serat yang reformasi
selulosa polimer dengan quenching asam. Persamaan
umum berikut menggambarkan transformasi ini. Serat
Produk ini disebut rayon
viscose .
ROH |
NaOH
|
RO (-) Na (+) + S = C = S |
RO- CS 2 (-) Na (+) |
H 3 O (+)
|
ROH |
|
selulosa
|
viscose solusi
|
rayon
|

Baru-baru ini, gum guar telah menjadi unsur penting bagi pertambangan minyak dan gas alam dalam proses yang disebut patahan hidrolik. Permintaan untuk guar telah meningkat sedemikian rupa sehingga para petani miskin di India barat laut telah hidup mereka berubah oleh kekayaan tak terduga.